欢迎访问39肿瘤网!
以明生物IO-108临床试验,评估IO-108注射液单药及联合抗PD-1单克隆抗体治疗晚期或转移性实体瘤安全性、耐受性、药代动力学和初步有效性的I期临床试验
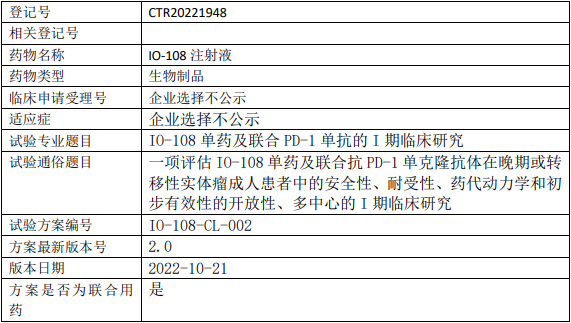
试验目的
1、评价IO-108在晚期或转移性实体瘤受试者中的安全性和耐受性,确认中国患者的II期推荐剂量(RP2D);
2、评价IO-108联合帕博利珠单抗或替雷利珠单抗在晚期或转移性实体瘤患者中的安全性和耐受性,并确认在中国患者中的RP2D;
3、评价IO-108联合帕博利珠单抗或替雷利珠单抗治疗特定晚期或转移性实体瘤患者的初步抗肿瘤活性。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄 ≥ 18岁,且不超过75岁。
2、A部分和B部分:根据病理学报告,患有经组织学或细胞学确诊的,且经系统性标准治疗失败,或目前尚无有效标准治疗,或现阶段不适用于标准治疗的晚期/转移性实体瘤受试者。任何类型的实体瘤均可入选。C部分:根据转化科学数据和临床有效性数据,选择经组织学或细胞学确诊的患有特定瘤种晚期/转移性实体瘤受试者。
3、研究中心评估至少存在一个可测量病灶(根据RECIST v1.1)。
4、东部肿瘤协作组(ECOG)体能状态评分为0~1。
5、具有充分的血液学功能,肝功能和肾功能。
排除标准
1、既往接受过靶向LILRB2/免疫球蛋白样转录物4(ILT4)的单克隆抗体(包括IO-108)治疗。
2、研究药物首次给药前4周内接受过化疗、放疗、生物治疗、靶向治疗、免疫治疗或其他未上市的临床试验研究药物或治疗等抗肿瘤治疗
3、首次给药前14天内需要使用全身用皮质类固醇(泼尼松剂量>10mg/天或等效剂量)或其他免疫抑制剂治疗。
4、患有放射性肺炎、非感染性肺炎或间质性肺疾病病史者(除外不需要激素治疗的放射性肺纤维化)。
5、具有临床症状的脑转移或脑膜转移。