欢迎访问39肿瘤网!
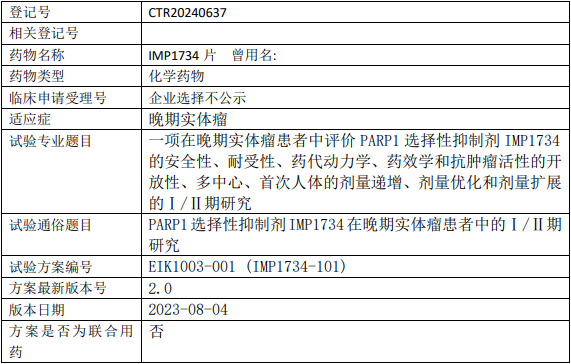
瑛派药业IMP1734临床试验,评价PARP1选择性抑制剂IMP1734片治疗晚期实体瘤安全性、耐受性、药代动力学、药效学和抗肿瘤活性的I/II期临床试验
试验目的
1、评价IMP1734的安全性和耐受性,确定最大耐受剂量(或最高可达剂量)和推荐的扩展剂量(RDE),以及评估IMP1734的抗肿瘤活性;
2、评价IMP1734单次/多次给药后在晚期实体瘤患者中的药代动力学(PK)特征及有效性;
3、评价IMP1734在晚期实体瘤患者中的药效学(PD)特征、疗效与生物标志物之间的关系、对QTc间期的影响、食物效应等。
试验设计
试验分类:安全性和有效性
试验分期:其它其他说明:Ⅰ/Ⅱ期
设计类型:单臂试验
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、患者必须自愿参加研究,愿意并能够提供签署的知情同意,并遵守研究访视和研究相关程序。
2、患者在签署知情同意书当日年龄必须≥18岁。
3、患者罹患经组织学或细胞学证实的晚期恶性肿瘤且适合研究治疗。
4、患者具有特定的HRR突变。
5、在进入研究前可评估疾病进展。
6、美国东部肿瘤协作组(ECOG)体能状态为0至1。
7、预期寿命必须≥12周。
8、具有良好的器官功能。
排除标准
1、在研究药物首次给药前28天或5个半衰期(以较短者为准)内接受过任何试验用或获批的抗肿瘤治疗。
2、既往接受过PARP1选择性抑制剂治疗的患者。
3、在接受研究药物首次给药接受过重大手术或接受过大范围放疗。
4、在研究药物首次给药前2年内患有其他需要治疗的恶性肿瘤的患者将被排除,但除外接受过根治性治疗的局部可治愈的基底或鳞状细胞皮肤癌以及接受过治疗且在2年内未复发的其他恶性肿瘤。
5、既往出现的任何治疗相关毒性尚未恢复的患者。
6、存在活动性或未经治疗的CNS转移和/或癌性脑膜炎的患者。
7、QTcF>470ms或QTcF<340ms。
8、其他心血管疾病的患者。
9、发生方案规定的活动性感染的患者。
10、根据研究者的判断,会显著增加患者参与本研究相关风险或影响其接受研究药物或完成研究能力的任何其他重大疾病。
11、既往有骨髓异常增生综合征(MDS)或急性髓系白血病(AML)诊断记录的患者,或接受过移植的患者,包括既往接受过同种异体骨髓移植的患者。
12、具有任何已知的出血倾向的患者。
13、因任何原因需要连续使用剂量>10mg泼尼松/天或等效剂量的皮质类固醇。
14、已知对研究药物或其任何成分有过敏史的患者。
15、无法吞咽口服药物或患有吸收不良综合征或任何其他可能影响生物利用度的控制不良的胃肠道疾病的患者。
16、怀孕或哺乳的女性患者。
17、已知有酗酒或药物滥用史的患者。
18、参与另一项研究且在研究药物首次给药前28天或五个半衰期(以较短者为准)内接受了试验用药品给药的患者,例外情况为,如果患者参与了另一项观察性研究,且没有与本研究相冲突的程序,则患者仍可能参加本研究。
19、在研究药物首次给药前28天内使用过试验用器械。