欢迎访问39肿瘤网!
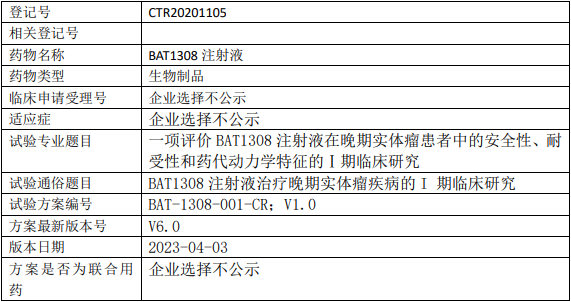
百奥泰BAT1308临床试验,评价BAT1308注射液治疗晚期实体瘤安全性、耐受性和药代动力学特征的I期临床试验
试验目的
主要目的
评价BAT1308注射液在晚期实体瘤患者中的安全性与耐受性,探索最大耐受剂量(MTD)。
次要目的
1、评价BAT1308注射液在晚期实体瘤患者中单次给药和多次给药的药代动力学(PK)特征;
2、评价BAT1308注射液的免疫原性;
3、评价BAT1308注射液的药效学特性;
4、初步评价BAT1308注射液的抗肿瘤疗效。
探索性目的
探索PD-L1表达水平与BAT1308注射液抗肿瘤疗效间的相关性。
试验设计
试验分类:安全性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年龄18至75周岁(含边界值),性别不限。
2、自愿签署知情同意书。
3、研究人群:经病理学确诊的、标准治疗失败或标准治疗不耐受的晚期恶性实体肿瘤患者。
4、根据RECIST1.1标准,至少存在一个可测量的肿瘤病灶。
5、ECOG评分要求为0分或1分。
6、研究者评估预期生存期≥12周。
7、具备足够的器官和骨髓功能。
8、具有生育能力的女性患者,必须在首次给药前7天内血清妊娠试验阴性并且愿意在研究期间直至研究最后一次给药后6个月内采取有效的节育/避孕方法防止妊娠;男性患者必须同意在研究期间直至研究最后一次给药后6个月内,采取有效的避孕方法。
排除标准
1、正在参与或在此研究首次给药前4周内曾参加过试验性药物或医疗器械的临床研究。
2、首次给予研究药物前4周内抗肿瘤治疗所致AE未恢复至CTCAE5.0≤1级的患者,脱发除外。
3、首次给予研究药物前4周内接受过大手术(如开颅、开胸或开腹手术),大手术这里定义为3、4级手术;具有器官移植手术史者。
4、在过去6个月内有食管或胃静脉曲张出血的患者。
5、严重的心血管疾病:美国纽约心脏病协会分级(NYHA)为2级及以上的心力衰竭、左室射血分数(LVEF)<50%、不稳定的心律失常或不稳定的心绞痛、无法控制的高血压(本方案定义为虽然采用最优的抗高血压治疗,但治疗后收缩压>150mmHg和/或舒张压>100mmHg)。
6、有自身免疫性疾病史的患者。
7、存在具有临床意义的、需要全身治疗的活动性感染,包括肺结核患者。
8、存在下列疾病感染者:
●人类免疫缺陷病毒(HIV)感染;
●梅毒螺旋体抗体阳性;
●乙肝病毒感染者[如果乙肝表面抗原(HBsAg)或核心抗体(HBcAb)任一一项呈阳性时,乙肝病毒的脱氧核糖核酸(HBVDNA)检测>2000IU/ml(或1×104拷贝/mL);
●丙肝病毒感染者[ HCV抗体及病毒核糖核酸(HCV RNA)检测结果阳性]。
9、筛选前4周内接种过或计划在研究期间内接种活/减毒疫苗。
10、已知对任何一种单克隆抗体发生过严重超敏反应。
11、已知有精神类药物滥用或吸毒史,并被认为会影响本研究依从性的患者。
12、孕妇或哺乳期妇女。
13、研究者认为其它不适合参与本研究的患者。