欢迎访问39肿瘤网!
礼来苏州LY3537982临床试验,评价LY3537982胶囊治疗携带KRAS G12C突变晚期实体瘤药代动力学、安全性、耐受性和抗肿瘤活性的I期临床试验
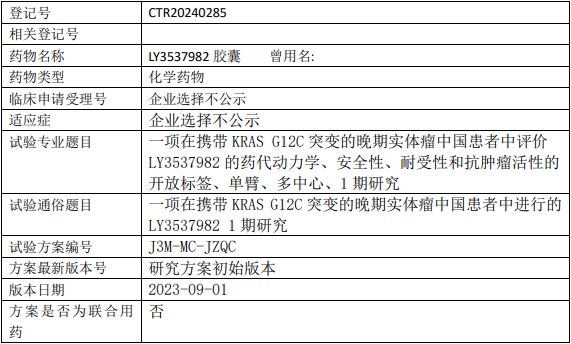
试验目的
主要目的
在携带KRAS G12C突变的晚期实体瘤中国患者中评价口服LY3537982单药治疗的PK、安全性、耐受性和初步抗肿瘤活性。
试验设计
试验分类:药代动力学/药效动力学试验
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限 (最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、签署知情同意书(ICF)时,年龄必须≥18岁的中国本土患者。
2、根据RECIST 1.1版判定具有可测量病灶。
3、存在KRAS G12C突变的疾病。
4、根据组织学或细胞学结果确诊为局部晚期、不可切除和/或转移性肿瘤,且必须是研究治疗的适当候选者。
5、东部肿瘤协作组(ECOG)体能状态评分为0至1。
6、具有充分的实验室参数。
7、必须能够吞咽胶囊或片剂。
8、估计预期寿命≥12周。
排除标准
1、存在适合使用局部治疗治愈的疾病。
2、患有活动性真菌、细菌和/或未经治疗的活动性病毒感染。
3、存在可能阻碍该研究参与的严重基础疾病。
4、存在严重的心血管疾病。
5、存在未经治疗的活动性症状性中枢神经系统(CNS)恶性肿瘤或转移和/或癌性脑膜炎。
6、既往接受过任何KRAS G12C小分子抑制剂治疗。
7、妊娠或哺乳的女性。
8、已知对研究治疗LY3537982制剂中使用的任何成分有过敏反应。