欢迎访问39肿瘤网!
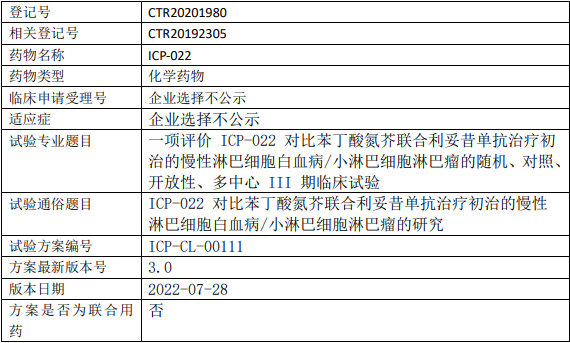
诺诚健华奥布替尼临床试验,评价奥布替尼片(宜诺凯、Orelabrutinib、ICP-022)对比苯丁酸氮芥联合利妥昔单抗治疗初治的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤的III期临床试验
试验目的
1、评价ICP-022 150mg,QD对比苯丁酸氮芥联合利妥昔单抗治疗初治CLL/SLL的疗效;
2、评价ICP-022单药对比苯丁酸氮芥联合利妥昔单抗治疗初治CLL/SLL的有效性(其它疗效指标)、安全性和耐受性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、男性或女性,>18岁
2、根据IWCLL2018标准,通过流式细胞术或组织病理确诊的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤,且CD20阳性;
3、根据IWCLL2018标准至少符合1条治疗指征
4、增强的计算机化断层成像/核磁共振成像(CT/MRI)检测有可测量的病灶;
5、ECOG体力评分0-2分
6、预期生存时间>6个月
7、主要器官功能符合以下标准:
a)在7天内无生长因子支持治疗(聚乙二醇化髓系生长因子则需要14天)或输血的情况下血常规符合:中性粒细胞绝对值≥0.75×109/L,血小板≥50×109/L;
b)血生化:总胆红素≤2倍ULN(除非确诊吉尔伯特综合征);AST或ALT≤2.5倍ULN;
c)凝血功能:国际标准化比率(INR)和活化部分凝血酶时间≤1.5倍ULN;
d)肌酐清除率≥30mL/分(Cockcroft-Gault评估)。
8、试验筛选前自愿签署书面知情同意书。
排除标准
1、目前或既往患有其他恶性肿瘤,除非进行了根治性治疗且有近5年内无复发转移的证据
2、中枢神经系统(CNS)受累或存在此类病史;
3、任何Richter转化病史或怀疑发生Richter转化;
4、不能控制的自身免疫性溶血性贫血和特发性血小板减少性紫癜
5、既往接受过针对CLL/SLL的全身治疗(除外随机4周前的给药不足2周的未完成治疗方案);
6、随机前4周内接受过活疫苗、免疫制剂和研究药物;
7、需要持续接受皮质类固醇治疗。
8、有无法控制的或重要的心血管疾病;
9、筛选前2个月内有活动性出血;
10、随机前6个月内曾经脑卒中或颅内出血患者;
11、临床上明显的胃肠道异常,可能影响药物的摄入、转运或吸收(如无法吞咽、慢性腹泻、肠梗阻等),或全胃切除;
12、随机前4周内进行过外科大手术;
13、未能控制的活动性全身性真菌,细菌,病毒或其他感染;
14、活动性或未控制的HBV(HBsAg阳性和/或HBcAb阳性且HBVDNA滴度阳性)、HCVAb阳性、HIV阳性;
15、对ICP-022、苯丁酸氮芥、利妥昔单抗或适用研究药物的任何其他成分存在超敏反应;
16、首次接受研究药物前两周内或计划在本研究中使用具有CYP3A强效抑制作用或强效诱导作用的药物或食物;
17、任何精神或认知障碍,可能会限制其对知情同意书的理解、执行以及研究的依从性;
18、妊娠、哺乳期女性,或整个研究期间至结束服用研究药物180天以内不愿采取避孕措施的育龄受试者;
19、存在可能威胁生命的病患,或严重器官功能障碍,研究者认为不适合参加试验的情况。